诺贝尔奖“细胞自噬”是什么 人类细胞一个重要机制
- 来源:新浪科技
- 作者:skylark
- 编辑:豆角
北京时间10月3日消息,2016年度诺贝尔生理学与医学奖刚刚揭晓!获奖者为日本科学家大隅良典(Yoshinori Ohsumi),以奖励他在“细胞自噬机制方面的发现”。据报道,当大隅良典接到得奖通知时感到很惊讶,他说:“我很惊讶,我正在我的实验室。

细胞自噬是什么?
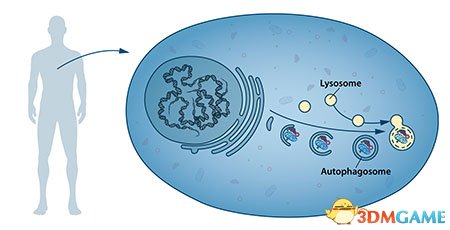
细胞自噬这是细胞组分降解与再利用的基本过程。“自噬”(autophagy)一词源于希腊语前缀“auto-”,意为“自我”,以及另一个希腊语单词“phagein”,意为“吞食”。因此,自噬作用的意思非常明确,那就是“自我吞噬”。
这一概念最早出现于上世纪1960年代,当时研究人员发现细胞能够消灭自身内部物质,方式是将其包裹进一个膜结构中,从而形成小型囊体并被输运至被称作“溶酶体”的回收机构进行分解。对这一过程开展研究非常困难,这也就意味着我们对其知之甚少。
直到上世纪1990年代,在经过一系列出色的实验之后,日本科学家大隅良典利用面包酵母找到了与自噬作用有关的关键基因。随后他开始致力于阐明酵母菌体内自噬作用的背后机制,并发现与之相似的复杂过程也同样存在于我们人类的细胞内。大隅良典的研究更新了我们关于细胞物质循环的旧有观点,他的研究开启了理解自噬作用在许多生理过程中关键作用的崭新道路,如生物体对于饥饿的适应或者机体对于感染的反应。自噬基因的突变会导致疾病的发生,自噬作用机制在一些类型的疾病,如癌症和神经疾病等病症中也发挥了作用。
我们人体的细胞内部拥有很多不同功能的细胞器,而溶酶体只是其中的一种,其内部含有能够消化自身细胞器的特殊酶。在细胞体内还能观察到大量存在的,被称作“吞噬小体”的特殊囊体。随着吞噬小体的形成,它会不断包裹细胞内部物质,如那些受损的蛋白质和其他细胞器。最后,这些小体会与溶酶体相结合,这一机制为细胞提供了营养与物质更新的途径。
突破性的实验

大隅良典活跃于多个研究领域,但在他于1988年最初建立自己实验室的时候,他主要致力于对液泡内的蛋白质降解进行研究,液泡的地位就类似于人体细胞内的溶酶体。酵母细胞相对比较容易开展研究,因此它们常被科学家们用做人类细胞模型。它们对于锁定复杂细胞机制背后的特定基因尤其有效。但大隅良典正面临一项挑战:酵母细胞很小,在显微镜能够下它们的细胞器并不容易分辨出来。因此此时的大隅良典甚至还不能确认在这种细胞内部是否存在自噬现象。
他推理认为,如果他能够打断正在进行中的细胞物质自噬降解过程,那么液泡内部就应该会聚集大量的自噬小体,从而在显微镜下变得可见。于是他培养了经过改造,缺乏液泡膜降解酶的酵母菌并通过饥饿的方法激活细胞的自噬机制。这一实验得到的结果是惊人的!在短短几小时内,细胞液泡内快速聚集起大量未能被降解的小型囊体。
在酵母菌体内(左侧)存在一个巨大的细胞器,名为液泡,其功能与人以及其他哺乳动物体内细胞内的溶酶体相类似。于是他培养了经过改造,缺乏液泡膜降解酶的酵母菌并通过饥饿的方法激活细胞的自噬机制。此时,当这些酵母菌遭受饥饿时,吞噬小体开始在液泡内部大量聚集(右图)。大隅良典的实验证明酵母菌内部存在自噬现象。此后,大隅良典教授对数以千计的酵母菌变异样本进行了核对(右侧),并从中找到了据信与自噬作用密切相关的15组基因。
这些小型囊体是自噬小体。大隅良典的实验证明在酵母菌内部同样存在自噬作用。但更加重要的是,他现在有了一种方法去识别并观察在细胞自噬机制背后起到关键作用的基因。这是一项突破性的进展,大隅良典在1992年发表的文章里相信进行了报告。
发现自噬基因
大隅良典开始利用其所克隆的酵母菌。在酵母菌被饿死的过程中,自噬体就会被积累。但如果自噬基因是灭活的,该积累过程就不会出现。大隅良典将酵母细胞暴露在一种化学物质下,随意引入多个基因的突变后,开始诱导自噬。这种做法奏效了!在发现酵母自噬现象后的一年内,大隅良典又发现了导致自噬的第一个基因。在后来的一系列研究中,由这些基因所编码的蛋白质也被从功能层面上被识别。这些研究结果表明,自噬由一连串的蛋白质和蛋白质复合物所控制,每一个都掌管着自噬体的萌生和形成的不同阶段。
自噬—人类细胞的一个重要机制
在发现酵母自噬机制后,一个核心问题油然而生:在其他生物体中是否也有一个相应的机制来控制这一过程?很快就有了答案,在人类细胞中也运行着几乎同样的机制。如今,用于研究人体自噬重要性的工具也已经诞生。
得益于大隅良典及后来者的贡献,我们现在知道,自噬控制着重要的生理功能。自噬能快速地为体内能量(energy)提供燃料,因此对“细胞对饥饿的响应”、及其他类型的压力至关重要。被感染之后,自噬能消灭掉入侵的细胞菌和病毒。自噬还影响着胚胎的发展和细胞变异。此外,细胞还利用自噬来消除受损的蛋白质和细胞器。这是一种高质量的控制机制,对抵抗年老所所导致的不良影响至关重要。




























玩家点评 (0人参与,0条评论)
热门评论
全部评论